发布日期:2025-12-30 02:54 点击次数:124
南京大学郑鹏团队刚刚完成了一项颠覆性突破:他们设计出一种力学强度达到1000皮牛顿级别的人造蛋白质,比人体肌肉组织中的天然蛋白质坚韧四倍以上,并能在150摄氏度高温下保持稳定。这项发表在《自然·化学》的研究,不仅打破了蛋白质怕热的固有印象,更标志着人类首次通过AI系统性地设计出性能远超自然产物的生物材料。
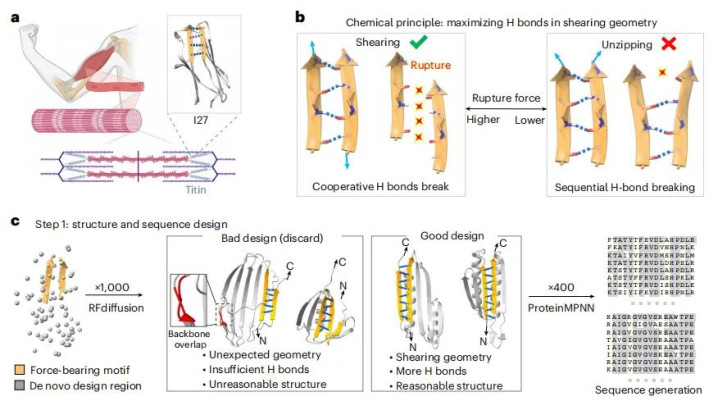
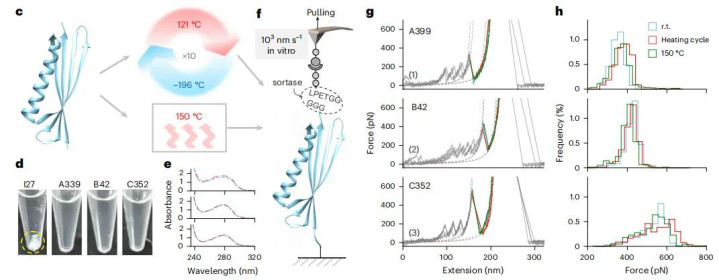
突破的起点是一个关键观察。人体肌肉的弹性来自肌联蛋白,它由数百个球状结构域串联而成。其中名为I27的结构域在原子力显微镜下呈现三明治状结构,内部由β折叠片通过氢键连接。当肌肉拉伸时,这些氢键会断裂,但断裂方式决定了所需力量。
关键在于氢键断裂的几何模式。如果外力使β折叠片像拉开拉链一样逐个断开氢键,所需力量较小。但如果外力导致折叠片之间发生剪切式错位,迫使所有氢键同时承受应力,所需力量就会大幅增加。自然界最坚韧的材料——蜘蛛丝、贻贝粘附蛋白——都利用了这种剪切氢键机制。郑鹏团队意识到,蛋白质的力学强度本质上取决于剪切模式下同时受力的氢键数量。
AI驱动的分子工程革命
理解原理与实现突破之间横亘着巨大的技术鸿沟。天然I27包含约4对关键的剪切氢键,对应200皮牛顿的解折叠力。但如何设计出具有8对、13对甚至33对剪切氢键的全新蛋白质?传统的随机突变筛选在这里几乎无能为力。
转折点来自生成式AI工具的成熟。郑鹏团队构建了一条精密的计算流水线。首先,从I27中提取负责承力的两条核心β链,作为设计约束输入RFdiffusion模型。这个蛋白质骨架生成器能够围绕给定的结构元素,生成数万个全新的三维骨架,许多成功延长了β链并增加了潜在的氢键位点。
生成骨架只是第一步。每个骨架需要匹配能够折叠成该构型的氨基酸序列。ProteinMPNN模型在这里发挥作用——它能为单个骨架设计出数百种不同的序列方案。但哪些序列真能折叠成预期结构?团队采用两层验证策略:先用ESMFold对成千上万个序列进行初筛,得分最高的候选序列再交给AlphaFold2进行最终评估。只有预测结构与设计目标高度吻合、置信度评分接近满分的设计才能进入下一轮。
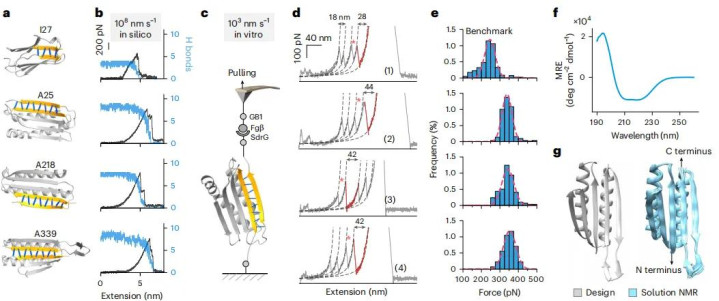
通过AI筛选的候选蛋白质还需要接受虚拟的物理测试。团队使用分子动力学模拟技术,在超级计算机中构建模拟系统。通过牵引模拟直接测量虚拟蛋白质的解折叠力,通过退火模拟评估其热稳定性。这些计算实验淘汰了大量在理论上可行但实际性能不佳的设计。
经过层层筛选,从最初的20万个候选中,团队锁定了数十个最有前景的设计,并将它们命名为SuperMyo系列。整个设计过程体现了AI时代科研的新范式:先在计算机中进行海量的虚拟实验,只把最有希望的方案拿到现实中验证。
从分子到材料的性能飞跃
计算预测需要实验验证。团队将SuperMyo的基因序列导入大肠杆菌,成功表达并纯化出真实的蛋白质。单分子拉伸实验证实了设计的成功:第一代SuperMyo A339的解折叠力达到350皮牛顿,比天然I27提升40%。通过迭代优化,他们逐步开发出B、C、D、E、F系列,最强的F553解折叠力超过1000皮牛顿,是天然版本的五倍。
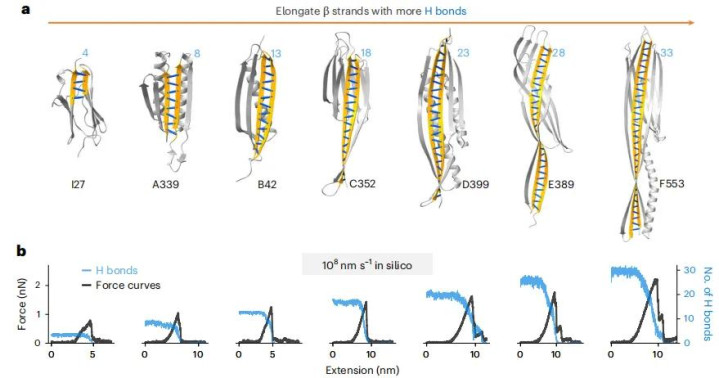
数据清晰显示了线性关系:氢键对数从4个增加到33个,对应的力学强度从200皮牛顿线性增长到1000皮牛顿。这不仅验证了设计原理,更提供了一个可定制的蛋白质强度谱系——未来研究者可以根据应用需求,选择具有特定力学性能的分子组件。
SuperMyo的优势不仅在于强度。天然I27在70摄氏度左右就会变性失活,而SuperMyo即使加热到100摄氏度其二级结构仍保持稳定,某些变体甚至能承受150摄氏度。这种热稳定性源于密集的氢键网络。
团队进一步展示了从单分子到宏观材料的转化潜力。他们利用SpyTag/SpyCatcher系统,将SuperMyo与四臂聚乙二醇交联,制备出透明的水凝胶。对比实验展现了惊人的差异:用天然I27制备的水凝胶在80摄氏度时浑浊软化,而SuperMyo水凝胶在121摄氏度的高压蒸汽灭菌条件下仍保持透明和凝胶态。
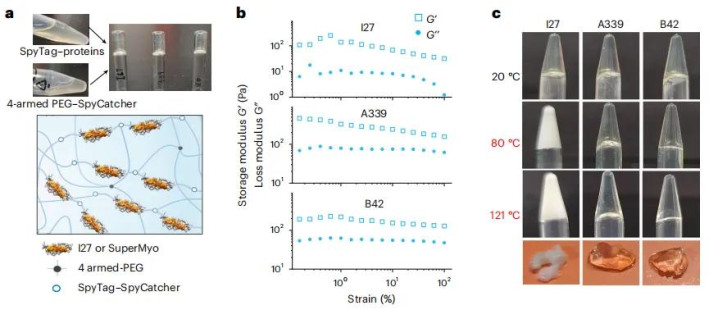
这个特性具有重大实用价值。目前的蛋白质基生物材料无法耐受高温灭菌,限制了其在需要严格无菌的医疗植入应用中的使用。SuperMyo水凝胶可以直接高压灭菌,为开发长期植入的人造组织、伤口敷料、药物缓释系统等铺平了道路。
郑鹏强调,这项工作的意义超越了创造几个性能记录。它证明了一种可推广的蛋白质理性设计范式:将深刻的物理化学原理与AI生成工具和分子模拟相结合,就能创造出自然界不存在的、性能超越天然产物的生物分子。从更宏观的视角看,这项研究标志着合成生物学正在从"复制自然"向"超越自然"转变。AI的介入使得全新的可能性成为现实——不仅可以编辑现有蛋白质,还能从零开始设计具有特定性能、甚至超越所有天然版本的分子机器。当AI赋予我们重写生命分子的能力时,蛋白质工程的边界正在被重新定义。